研究内容研究の紹介
研究の紹介
1.がんの分子生物学
医学の進歩は、着実にがんの予後を改善してきています。しかしながら、依然として日本人の死因第一位はがんです。近年の分子生物学の発展により、「ゲノミクス」、「トランスクリプトミクス」、「プロテオミクス」、「メタボロミクス」などの網羅的解析手法を駆使した研究が可能となってきました。ゲノミクスはゲノム配列そのものを読み取る主に質的な解析手法であり、トランスクリプトミクス及びプロテオミクスは遺伝子産物であるmRNA及びタンパク質を主に量的に解析する手法です。また、メタボロミクスは様々な生理現象の結果生じた代謝産物の網羅的解析手法です。疾患や治療によって特異的に変動する分子を同定することで、機序の解明、予後の予測、新薬の創生が可能になると考えられています。教室では、トランスクリプトミクスの一つであるDNAチップから得られた成果をはじめ、山口県の支援を受けて次世代シーケンサー (NextSeq 500) を導入して臨床検体の解析を進めています。その成果は、後述のがん免疫療法や体外診断薬へとつながっています。
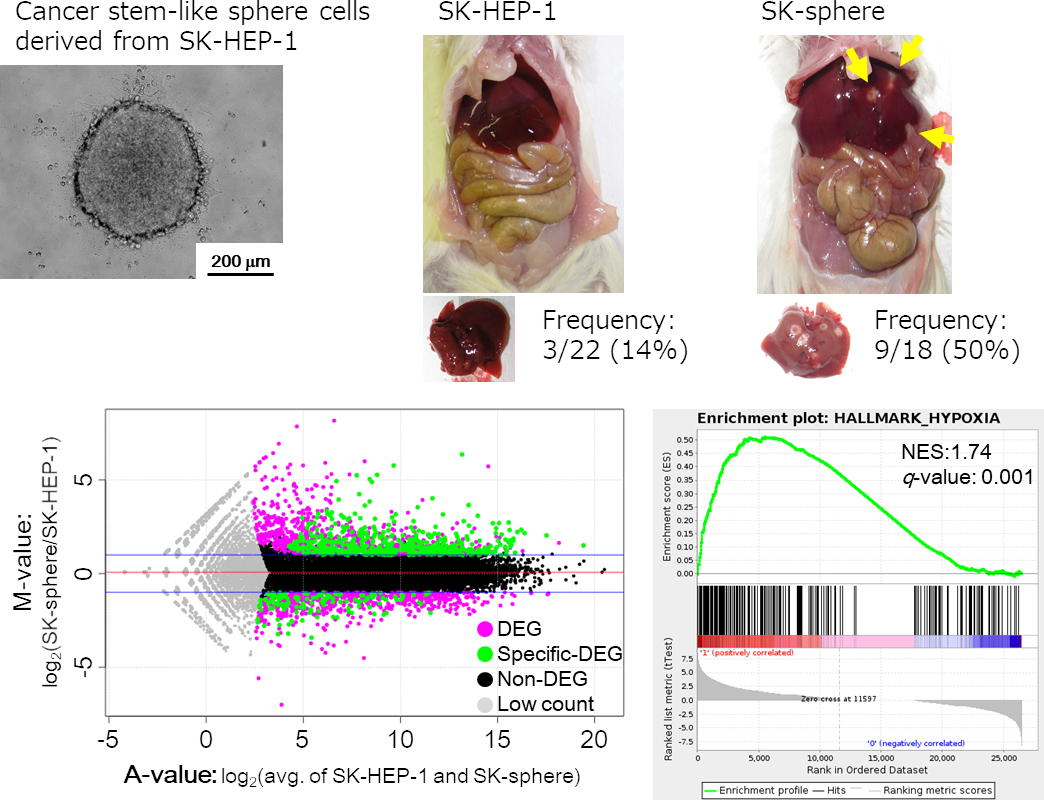
私たちの教室では、がんの予後改善に向けて、がんの転移や抗がん剤抵抗性の機序解明に取り組んでいます。その中で「がん幹細胞」は、自己複製能・造腫瘍能だけでなく転移や治療抵抗性にも大きく関与していることから、重要な治療標的です。教室ではこの「がん幹細胞」に着目し、消化器がん細胞株からがん幹細胞を濃縮させる培養条件を開発しました (特許6090735)。がん幹細胞は、がん組織中に極僅かしか存在しませんが、この手法から得られる大量のがん幹細胞としての特性を有する細胞に対して、上述の網羅的解析による全遺伝子発現の比較データを山口大学大学院知能情報工学 (浜本義彦 教授) が開発したアルゴリズムに適用することで、がん幹細胞に有効な治療標的遺伝子を探索しています。標的遺伝子について、予後との関連性の確認や、RNA干渉法やゲノム編集を用いて機能解析を行い、新たな治療標的分子の探索を行っています。さらに臨床検体から得られた知見を基に、主にin vitroやマウスでの基礎的解析を進めています。
Hashimoto N, et al. BMC Cancer (2014) 及びNishiyama M, et al. Cancer Sci. (2018) より改変
論文 (がんの分子生物学:2015年以降)
- Fujiwara Y, et al. Pancreatic Cancer Stem-Like Cells With High Calreticulin Expression Associated With Immune Surveillance. Pancreas. 50: 405–413 (2021).
- Fujimoto T, et al. Cathepsin B is highly expressed in pancreatic cancer stem-like cells and is associated with patients’ surgical outcomes. Oncol Lett. 21: 30 (2021).
- Tsunedomi R, et al. Clinical implications of cancer stem cells in digestive cancers: acquisition of stemness and prognostic impact. Surg Today. 50: 1560–1577 (2020). Review
- Iida M, et al. Overexpression of miR‑221 and miR‑222 in the cancer stroma is associated with malignant potential in colorectal cancer. Oncol Rep. 40: 1621-1631 (2018).
- Nishiyama M, et al. Metastatic ability and the epithelial-mesenchymal transition in induced cancer stem-like hepatoma cells. Cancer Sci. 109: 1101–1109 (2018).
- Matsukuma S, et al. Calreticulin is highly expressed in pancreatic cancer stem-like cells. Cancer Sci. 107: 1599-1609 (2016).
2.がん免疫
人間の体の中では、遺伝子異常などによってがん細胞が生じていますが、「免疫監視機構」によって、がん細胞を早期に排除する仕組みも有しています。しかし、がんは免疫監視機構から様々な方法で逃避しています。がん治療においては、免疫逃避機構の一部を解除する免疫チェックポイント阻害剤の登場によって、がん免疫療法は、手術、化学療法、放射線療法に続く第4のがん治療としての地位を確立しました。私たちの教室では、がんの免疫逃避機序の解明とがん免疫療法の開発を行っています。
がんの免疫逃避機序の解明については、前述のがん幹細胞における分子生物学的解析や、後述のがん免疫療法の臨床試験を受けられた方の免疫細胞や腫瘍微小環境の解析を行っています。また、がん細胞の目印となる抗原について、肝細胞がん (HCC) のプロテオミクス解析や血中抗HSP70抗体測定から、ヒートショックプロテイン (HSP) の一つであるHSP70がHCCで高発現していることを見出し、これをがん抗原の一つとして後述のがん免疫療法に応用 (がんを認識・攻撃する免疫細胞を増やす) しています。山口大学大学院医学系研究科免疫学講座 (玉田耕治 教授) との共同研究から、リンパ球の特異的誘導に加えてリンパ球の免疫疲弊の解除に有効な複合アジュバント (LAG-3Ig + Poly-ICLC) を見いだし、これも私たちのがん免疫療法に応用 (免疫逃避機構の解除) しています。
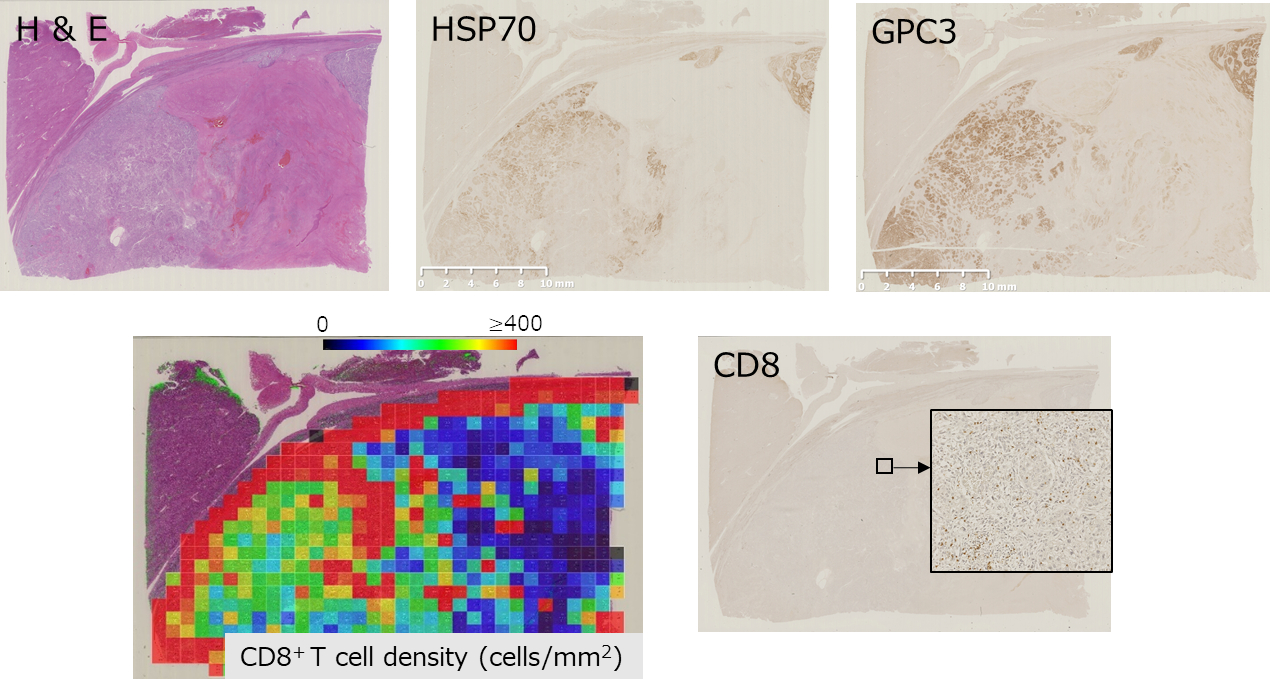
がん免疫療法の開発については、がんを認識・攻撃する免疫細胞を増やす細胞療法の開発を行ってきましたが、現在は、がんペプチドと複合免疫アジュバントを用いた次世代型ペプチドワクチン療法の開発に取り組んでいます。免疫細胞にがんを認識させるために用いるペプチドについては、前述のHSP70に加えてHCCに高発現するGPC3タンパクを標的としたマルチHLA結合性配列を人工知能によって選定し (日本電気株式会社:NECとの共同開発)、複合アジュバント (LAG-3Ig + Poly-ICLC) と一緒に用いることで、新規がんペプチドワクチン療法を開発し、進行・再発固形がん (膵がん、大腸がん、胃がん、食道がん、肝がん並びに乳がん) に対する第I相試験 (YNP01試験 JRCTs061180058) を行いました (NEC、サイトリミック株式会社との共同研究)。この特定臨床研究では、安全性とともに高いペプチド特異的リンパ球の誘導が確認されました。そこで、根治切除可能HCCを対象とした手術前から手術後にかけての周術期ワクチン療法の第I相試験 (YCP02試験 jRCTs061180033) を行いました (サイトリミック株式会社との共同研究)。現在、論文を準備中ですが、付随研究からHCC腫瘍内部に多数のリンパ球を浸潤させることが示されています。この試験で得られた腫瘍浸潤T細胞 (TIL) などのシングルセル解析を通じての腫瘍免疫微小環境での免疫抑制機序の解明や、腫瘍遺伝子変異に由来する新抗原 (ネオアンチゲン) の研究によって、慶応大学病理学教室(坂元亨宇 教授)とも協力し、さらなるがん免疫療法の開発に取り組んでいます。
ペプチドワクチン療法による腫瘍抗原発現部位への腫瘍浸潤T細胞の集積
論文 (がん免疫:2015年以降)
- Matsui H, et al. Novel adjuvant dendritic cell therapy with transfection of heat-shock protein 70 messenger RNA for patients with hepatocellular carcinoma: a phase I/II prospective randomized controlled clinical trial. Cancer Immunol Immunother. 70: 945-957 (2021).
- Yamada K, et al. Siglec-7 is a predictive biomarker for the efficacy of cancer vaccination against metastatic colorectal cancer. Oncol Lett. 21: 10 (2021).
- Nakajima M, et al. A phase I study of multi-HLA-binding peptides derived from heat shock protein 70/glypican-3 and a novel combination adjuvant of hLAG-3Ig and Poly-ICLC for patients with metastatic gastrointestinal cancers: YNP01 trial. Cancer Immunol Immunother. 69: 1651-1662 (2020).
- Kuwahara T, et al. Intratumoural-infiltrating CD4 + and FOXP3 + T cells as strong positive predictive markers for the prognosis of resectable colorectal cancer. Br J Cancer. 121: 659-665 (2019).
- Matsui H, et al. Identification of a Promiscuous Epitope Peptide Derived From HSP70. J Immunother. 42: 244-250 (2019).
- Matsui H, et al. Combination treatment of advanced pancreatic cancer using novel vaccine and traditional therapies. Expert Rev Anticancer Ther. 18: 1205-1217 (2018).
- Hazama S, et al. Current status of immunotherapy against gastrointestinal cancers and its biomarkers: Perspective for precision immunotherapy (Review). Ann Gastroenterol Surg. 2: 289-303 (2018).
- Kamei R, et al. Expression levels of UL16 binding protein 1 and natural killer group 2 member D affect overall survival in patients with gastric cancer following gastrectomy. Oncol Lett. 15: 747-754 (2018).
- Shindo Y, et al. Predictive biomarkers for the efficacy of peptide vaccine treatment: based on the results of a phase II study on advanced pancreatic cancer. J Exp Clin Cancer Res. 36: 36 (2017).
- Konagai A, et al. Correlation Between NKG2DL Expression and Antitumor Effect of Protein-bound Polysaccharide-K in Tumor-bearing Mouse Models. Anticancer Res. 37: 4093-4101 (2017).
- Matsui H, et al. Postoperative Adjuvant Therapy for Resectable Pancreatic Cancer With Gemcitabine and Adoptive Immunotherapy. Pancreas. 46: 994-1002 (2017).
- Inoue Y, et al. Cetuximab strongly enhances immune cell infiltration into liver metastatic sites in colorectal cancer. Cancer Sci. 108: 455-460 (2017).
- Suzuki N, et al. Phase II clinical trial of peptide cocktail therapy for patients with advanced pancreatic cancer: VENUS-PC study. Cancer Sci. 108: 73-80 (2017).
3.バイオマーカー探索
私たちは、これまでに蓄積された臨床検体からバイオマーカー探索・検証を行っています。がんの予後や治療効果は、全ての患者で一様というわけではありません。免疫療法においても、効果のある人と効果のない人とに分かれます。そこで、免疫療法を受けられた患者さんより提供していただいた多数の臨床検体を解析し、どの様な病態に免疫療法がよく効くのか、どの様な病態では免疫療法の効果を下げているのか、効果のある症例を事前に予測 (患者層別化) する指標 (血中サイトカイン等) の探索研究も行っています。私たちは、消化器がんの予後診断への応用研究も推進しており、血中に遊離したがん細胞由来のDNAやマイクロRNAをバイオマーカーとした研究も行っています。
また、教室では、抗がん剤の副作用は患者さんの治療に直結するため極めて重要と考え、抗がん剤副作用の出現と関連する遺伝子多型を研究し、副作用の少ない個別化治療の開発にも力を入れています。現在、ゲノミクスから同定した遺伝子多型による膵がん化学療法 (mFOLFIRINOX及びGEM+nab-PTX) の副作用予測法を開発中です。私たちは皆が全て同じゲノム情報を持つのではなく、少しずつ異なっていて、多様性を持っています。ゲノム情報における多様性には、遺伝子多型やがん細胞における変異が含まれます。ゲノム情報の違いにより、酵素の量や活性に個人差が生じた結果、お酒に強い弱いと同様に、抗がん剤の効果・副作用や、手術侵襲に対する生体反応、がんの罹りやすさにも個人差が表れます。
研究成果の臨床応用として、臨床現場で遺伝子多型を測定する体外診断薬についても、企業と共同開発しています。これまでに、東洋鋼鈑株式会社様の金属表面加工技術によるDNAチップを応用した共同開発品である「UDPグルクロン酸転移酵素 (UGT1A1) 遺伝子多型キット」が、薬機法 (旧・薬事法) 承認・保険収載され上市されています(http://www.med.yamaguchi-u.ac.jp/news/news/post2015-012.html)。

提供:東洋鋼鈑株式会社
平成30年8月28日「山口県産業技術特別褒賞」表彰

論文・特許 (バイオマーカー:2015年以降)
- Nakashima-Nakasuga C, et al. Serum LOX-1 is a novel prognostic biomarker of colorectal cancer. Int J Clin Oncol. 25: 1308-1317 (2021).
- Shindo Y, et al. Novel Biomarkers for Personalized Cancer Immunotherapy. Cancers (Basel). 11: 1223 (2019). Review
- Kanekiyo S, et al. IgG response to MHC class I epitope peptides is a quantitative predictive biomarker in the early course of treatment of colorectal cancer using therapeutic peptides. Oncol Rep. 39: 2385-2392 (2018).
- Nakajima M, et al. High secreted protein acidic and rich in cysteine expression in peritumoral fibroblasts predicts better prognosis in patients with resectable gastric cancer. Oncol Lett. 15: 803-812 (2018).
- Tanaka H, et al. miR-125b-1 and miR-378a are predictive biomarkers for the efficacy of vaccine treatment against colorectal cancer. Cancer Sci. 108: 2229-2238 (2017).
- Shindo Y, et al. miR-196b, miR-378a and miR-486 are predictive biomarkers for the efficacy of vaccine treatment in colorectal cancer. Oncol Lett. 14: 1355-1362 (2017).
- Tsunedomi R, et al. Rapid and sensitive detection of UGT1A1 polymorphisms associated with irinotecan toxicity by a novel DNA microarray. Cancer Sci. 107: 1504-1509 (2017).
- Sakamoto K, et al. Association of tumor necrosis factor-α polymorphism with chemotherapy-induced oral mucositis in patients with esophageal cancer. Mol Clin Oncol. 6: 125-129 (2017).
- Kijima T, et al. MicroRNA-6826 and -6875 in plasma are valuable non‑invasive biomarkers that predict the efficacy of vaccine treatment against metastatic colorectal cancer. Oncol Rep. 37: 23-30 (2017).
- Kitahara M, et al. Prediction of the efficacy of immunotherapy by measuring the integrity of cell-free DNA in plasma in colorectal cancer. Cancer Sci. 107: 1599-1609 (2016).
- Sakamoto K, et al. Perioperative Microbiologic Monitoring of Sputum on Postoperative Day One as a Predictor of Pneumonia After Hepatectomy. J Gastrointest Surg. 19: 1662-1667 (2015).
論文 (がん免疫:2015年以降)
- 特願2021-095283 (2021/06/07)「膵がん化学療法における副作用発生リスクの予測を補助する方法」
- 特許6915804 (2021/07/19)「イリノテカンの治療効果予測方法及びそのためのキット」(東洋鋼鈑株市会社との共同出願)
- 特許6757942 (2020/09/03)「ハイブリダイゼーション用バッファー組成物及びハイブリダイゼーション方法」(東洋鋼鈑株市会社との共同出願)
- 特許6771203 (2020/10/01)「ペプチドワクチン療法の効果予測方法」
- 特許6644333 (2020/01/10)「イリノテカンによる副作用の発生リスクの予測を補助する方法」(東洋鋼鈑株市会社との共同出願)
- 特許6551967 (2019/07/12)「肝細胞がんの転移性再発リスクの予測方法」
